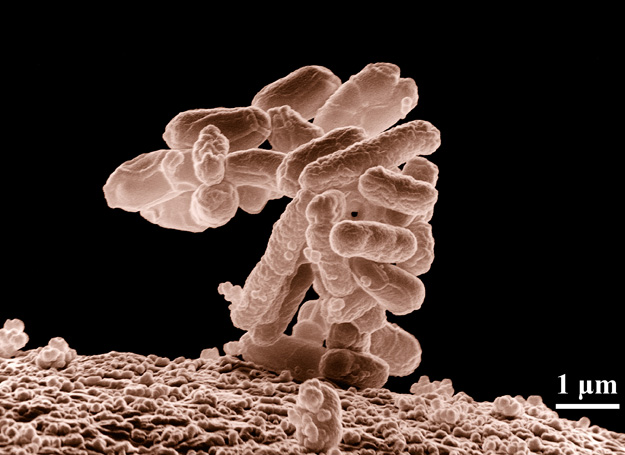
Ez az év is gazdag volt orvosi szenzációkban, új gyógymódok felbukkanásában és elterjedésében: ezek között kétségtelenül előkelő hely illeti meg a székletmikrobióta-transzplantációt. Az új kezelés természetesen egy igencsak elterjedt fertőzéshez dukál, amit a Clostridium difficile (CDI) nevű makacs bélbaktérium okoz, tünetei az enyhébb hasmenéstől a baktérium okozta súlyos kolitiszig (vastagbélhurutig) terjednek. A fertőzés különösképpen tarol azok között, akik maguk is bekerültek a kórházi ellátórendszerbe, esetükben hétszer nagyobb a megbetegedés esélye, de a kórházon kívül sem vagyunk biztonságban. Fokozottan veszélyeztetettek a 65 évesnél idősebbek, az immunkárosodott betegek, nők a szülés körüli időszakban és azok, akik gyulladásos bélbetegséggel vagy más súlyos, krónikus nyavalyával küszködnek. A CDI különösen agresszíven terjed, hiszen egy virulens és számos hagyományos antibiotikumnak ellenálló baktériumfajról van szó. Csak az Egyesült Államokban évente hárommillióan betegednek meg, közülük sokan a betegség igen súlyos változatát fejlesztik ki. A fertőzés mortalitása megdöbbentő: ott, a tengerentúlon naponta átlagosan 300-an veszítik életüket e bélbaj miatt, így az éves halálozás az USA-ban eléri a 110 ezret. Eddig csak a legbrutálisabb gyógyszeres kezeléssel lehetett felvenni ellene a harcot, csakhogy az ellenszerek, a vankomicin és társai nem csupán az invazív fajokat, hanem a hasznos baktériumflórát is kiirtják. A CDI terjedése mögött – paradox módon – éppen az intenzív, más betegségek elleni antibiotikumos kezeléseket sejtik, ugyanis ha ezek kipusztították belőlünk a hasznos baktériumflórát, ezt követően „gyomként” telepszik meg a béltraktusokban a C. difficile. Mivel a CDI nemcsak Amerikában, de Európában is rohamosan terjed, valami hatásosabb, ugyanakkor kevésbé agresszív kezelési módra volt szükség. Így leltek rá végül a székletmikrobióta-transzplantációra (rövidítve FMT, azaz fecal microbiota transplant), amely hatékonyan képes az egészséges vastagbélflóra helyreállítására. A laikusok számára tán meghökkentőnek tűnő eljárás során egy jó adag, mikrobában gazdag székletdarabot plántálnak át egy krónikus beteg vastagbelébe – megértéséhez nem árt áttekintenünk, kikkel is lakunk egy háztartásban.
| ||
Virágos mezők
A biológusok egyre inkább hajlamosak úgy tekinteni az emberre, mint egy összetett, számtalan organizmusból álló biológiai rendszer részére. Akarjuk-e vagy sem, mindannyian sok-sok billiónyi, többnyire aprócska, nanoméretű élőlénnyel élünk szoros életközösségben – ennek számos haszna akad, de az együttélésnek vannak kevésbé derűs és harmonikus mozzanatai is.
| Egy gyönyörű barátság Az emberi baktériumflóra felfogható önálló szervként is. Tömege több más szervünkhöz hasonlóan 1 kg körüli, ám olyan formában nem „megfogható”, mint a szív vagy a vese. Inkább az immunrendszer testünkben szétszórt sejtjeihez hasonlatos, melyek szintén nem formálnak egyetlen körülhatárolható szervet. A baktériumok mintegy száz nagy, egymástól elkülöníthető csoportja közül az ember bélrendszerében négy képviselteti magát: ezek az Actinobacteria, Bacteroidetes, Firmicutes és Proteobacteria fajok, melyek közül a két középső a leggazdagabb. Kontinensről kontinensre az emberekben élő baktérium-mikroflóra is eltérő mintázatot mutat. Egy Afrikában vagy Dél-Amerikában élő kisgyermek bélrendszerében például észak-amerikai vagy európai társaihoz képest jóval több riboflavint előállító baktérium él. Emellett az anyatejben található tápanyagok hasznosítása szintén hatékonyabb az ő esetükben. Több glikozid-hidroláz típusú enzim áll rendelkezésükre a tejben található komplex szénhidrátoknak a szervezetük számára hasznosítható egyszerű cukrokká alakításához. Az enzimet kódoló gének viszont nem találhatók meg a humán genomban, azt kizárólag a bélben élő baktériumok képesek előállítani – gyönyörűen példázva a koevolúció működési mechanizmusát. |
Becslések szerint a testünkben tízszer annyi mikroba él, mint amennyi a sejtjeink összlétszáma. Mi több, testünk társbérlői többé-kevésbé még egymástól is különböznek. A bennünk hordozott genetikai információ mennyiségének felmérésére elég legyen annyit mondanunk, hogy az emberi sejtek 23 ezer gént hordoznak, melyeket mind a szüleinktől örököltünk – ezzel szemben a baktériumflóránk összesített génszáma 3 millió! Kétségtelen, hogy e gének túlnyomó része ugyanazon tulajdonságok kialakításáért felelős, ugyanazon funkcióra szolgáló variáció, ám nem elhanyagolható azoknak a száma sem, amelyek már nem ebbe a kategóriába tartoznak, és a „rendszer” genetikai összetettségét növelik (lásd: Egy gyönyörű barátság című keretes írásunkat).
Az ember a testében élő baktériumokkal együtt képez egy szerves egészet, összefoglalóan ezt nevezzük mikrobiótának. Ez a szoros kötelék az együtt fejlődés, egymáshoz igazodás (koevolúció) sok évezredes, évmilliós folyamatának eredményeként jött létre. Az együttélés kölcsönös előnyökre épül, a nyersanyagért és a védett élőhelyért cserébe a bennünk élő baktériumok fontos tápanyagokkal látnak el minket. Emellett egészségvédő szerepük is van, vagyis hozzájárulnak a gazdaszervezet általános jóllétéhez. Az egyensúly azonban törékeny, előfordulhat, hogy valamilyen hatásra az addig hasznos vagy legalábbis ártalmatlan mikrobák ellenünk fordulnak, és megbetegítenek minket.
Tudjuk, hogy a baktériumok betegségeket okozhatnak, ám ezek köre nem azonosítható teljes egészében a jól ismert akut fertőzésekkel. Utóbbiakat a modern orvostudomány viszonylag sikeresen kezeli újabb és újabb gyógyszerekkel (habár az antibiotikumokkal szembeni rezisztencia igenis komoly probléma), ám a bennünk működő mikrobiótáról és ennek pontos szerepéről igen keveset tudunk. A fejlett országok lakosait jellemző krónikus betegségek – elhízás, cukor- és szívbetegségek, asztma, sclerosis multiplex és más neurológiai-pszichés betegségek, mint például az autizmus – esetében a bennünk lakó mikrobák szerepe lényegesen nagyobb lehet, mint korábban gondoltuk volna. (Bővebben lásd A Crohn-betegség példája című keretes írásunkat.)
Új hazát keres
Széklettel gyógyítani a beteg szervezetet, pláne a bélrendszert nem éppen új idea. A régi kínai orvosok több ezer évvel ezelőtt ismerték és alkalmazták a „sárga leves” módszerét: a vízzel kevert székletet ez esetben meg kellett innia a betegnek. Az első modern tanulmányt 1958-ban publikálták coloradói sebészek, akik, még a C. difficile szerepének tisztázása előtt, sikerrel kezelték súlyos, más módon nem gyógyítható kolitiszes betegeiket széklettranszfúzióval (fekáliabeöntéssel). Amúgy példát vehettünk volna számos emlőstől: az elefántok, a vízilovak, a pandák, a koalák steril bélrendszerrel születnek, s az emésztéshez nélkülözhetetlen saját bélflórájuk kialakításához előbb enniük kell saját édesanyjuk székletéből.
| A Crohn-betegség példája Számos immunrendszeri eredetű probléma mögött is a mikrobióta számunkra kóros megváltozását sejtik. Ez vezet ahhoz, hogy a szervezet, bár egy idegen organizmusra reagál (tehát nem klasszikus autoimmun betegségről van szó), végül sajnálatos mellékkövetkezményként saját magát támadja meg. Könnyen lehet, hogy ez rejlik az immunrendszer túlműködéséből eredő emésztőszervi gyulladásos kór, vagyis a Crohn-betegség mögött is: ilyen esetben a megsérült, károsodott bélbaktérium-mikroflóra (tipikus a Bacteroidetes törzs hiánya) az így kínálkozó „üres” helyekre más, invazív baktériumtörzsek (például E. coli baktériumok), esetleg egyéb mikroorganizmusok (például archeák) nyomulnak. Ezeknek a bélfalban való tevékenységét a szervezet támadásként érzékelheti, amire eltúlzott immunválasz a reakció, bár mindez csupán kiteljesíti a Crohn-betegségre való, amúgy is meglévő genetikai hajlamot. Éppen ezért lehet ígéretes a Crohn-betegség kezelésében is a széklettranszplantáció, hiszen az eredeti mikroflóra rekonstrukciójával csökkenthető a szervezetben jelentkező akut gyulladás. |
A székletmikrobióta-transzplantációhoz fűződő remények megértéséhez azért tudnunk kell, hogy a CDI jelenlegi terápiás esélyei nem túl kedvezőek. Jelenleg az enyhe fertőzést metronidazollal, a tartós vagy mérsékelten súlyos fertőzést pedig orális vankomicinnel vagy a nemrég engedélyezett fidaxomicinnel kezelik. Az első gyógyszerkör után a betegeknek akár ötödében is kiújulhat a CDI, márpedig akiben egyszer már kiújult, abban 40 százalékos valószínűséggel ismét megteszi. Ha valakiben kétszer vagy többször jelentkezett, 60 százalékos az újabb visszatérés (orvosi nyelven: relapszus) kockázata. Az egyre elfogadottabb kezelésnek tekintett FMT alkalmazásával foglalkozó újabb vizsgálatok szerint a visszatérő (rekurrens) CDI esetén az elsődleges gyógyulási arány 91 százalékos, vagyis megszűnnek a CDI tünetei, és az FMT-t követő 90 napon belül nem újulnak ki.
A másodlagos gyógyulási arány pedig már 98 százalékos, ami azt jelenti, hogy az FMT-t követő újabb vankomicinkúra után megszűnnek a tünetek. A mostani vizsgálatokban szerepeltek különösen súlyos betegek is: náluk különösen vonzó lehetőség az FMT alkalmazása, mivel egyszerű, olcsó, hatásos és biztonságos eljárás. Megjegyzendő, hogy az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága (FDA) tavaly befogadta a módszert, a gyógyítás, megelőzés vagy a diagnózis valamely fázisában használható szerként (drug) azonosítva a székletet. Igaz, egyelőre csak kísérleti kezelésként, és ezért szigorúbb szabályok vonatkoznak rá, esetenként engedélyt is kell kérni alkalmazására. A könnyebbség csupán annyi, hogy idén az FDA – tekintetbe véve, hogy számos betegnek ez az egyetlen esélye – jelentősen enyhítette a módszert alkalmazó gasztroenterológusokra nehezedő nyomasztó adminisztratív terhet. Az FMT hatásosságát firtató vizsgálatok óvatosságát jellemzi, hogy székletdonorként elsősorban családtagokat vagy első fokú rokonokat igyekeztek számításba venni. Csak ha ilyenek nem álltak rendelkezésükre, akkor jöhettek számításba donorként az egészséges „idegen” önkéntesek. A beteggel együtt élő családtagok előnye, hogy ugyanazoknak a kockázati tényezőknek vannak kitéve, mint a beteg, s ezért minimális annak a valószínűsége, hogy egy új fertőző ágenst visznek be a betegbe. Ugyanakkor a beteggel való együttélés miatt nagyobb valószínűséggel lehetnek C. difficile- hordozók, s ezért erre nézve a mintaadás előtt meg kell vizsgálni őket. A módszer technikai kivitelezéséhez egy irrigációhoz (beöntés, allövet, klistély) használt orvosi eszköz szükséges. Ezzel kell az átültetendő, alkalmanként 200–300 gramm friss székletet a beteg alfelébe pumpálni. A javallat szerint a széklet nem lehet régebbi hatórásnál, habár lefagyasztva később is alkalmazható, természetesen kiolvasztás után.
A jövő egyre inkább az egészséges önkéntesekre való hagyatkozás s a transzplantációt igénylők menedéke a mind szélesebb körben üzemelő székletbankok lehetnek. Érdekes módon az efféle, alacsony költségen működő nonprofit fekálialerakatok (mint az OpenBiome, mellyel részletesen foglalkozik a The New Yorker idei, december 1-jén megjelent összeállítása) működését éppen az veszélyezteti, hogy lassan a nagy gyógyszergyárak is beszállnak az üzletbe. Ők megtehetik, hogy sok millió dollárt költsenek vizsgálataikra, s így exkluzívan állítsanak elő gyógyszertörzskönyvezett székletet, amit már sokkal kevésbé szokatlan módon, mondjuk, egy zselatinkapszulába (szellemes kifejezéssel: crapsule) juttatnának a beteg szervezetébe.